12月4日,Eyepoint Pharmaceuticals(EyePoint)在官網發布新聞[1],EYP-1901治療濕性年齡相關性黃斑變性(w-AMD)的Ⅱ期臨床試驗DAVIO 2達到所有主要終點和次要終點。

DAVIO 2是以阿柏西普為對照組,針對先前接受過治療的w-AMD患者進行隨機、雙盲Ⅱ期臨床試驗,旨在探索EYP-1901在w-AMD患者中的療效和安全性并用以支持啟動III期臨床試驗。所有入組的受試者既往均接受過標準抗血管內皮生長因子(VEGF)治療,并被隨機分配到EYP-1901(2mg或3mg組)或阿柏西普對照組之一。DAVIO 2試驗的主要終點是從第一天到第28周和32周最佳矯正視力(BCVA)的平均變化差異;次要終點包括安全性、治療負擔減少程度、6個月內無需補充抗VEGF注射的比例和光學相干斷層成像(OCT)測量中心視網膜厚度(CST)的變化。
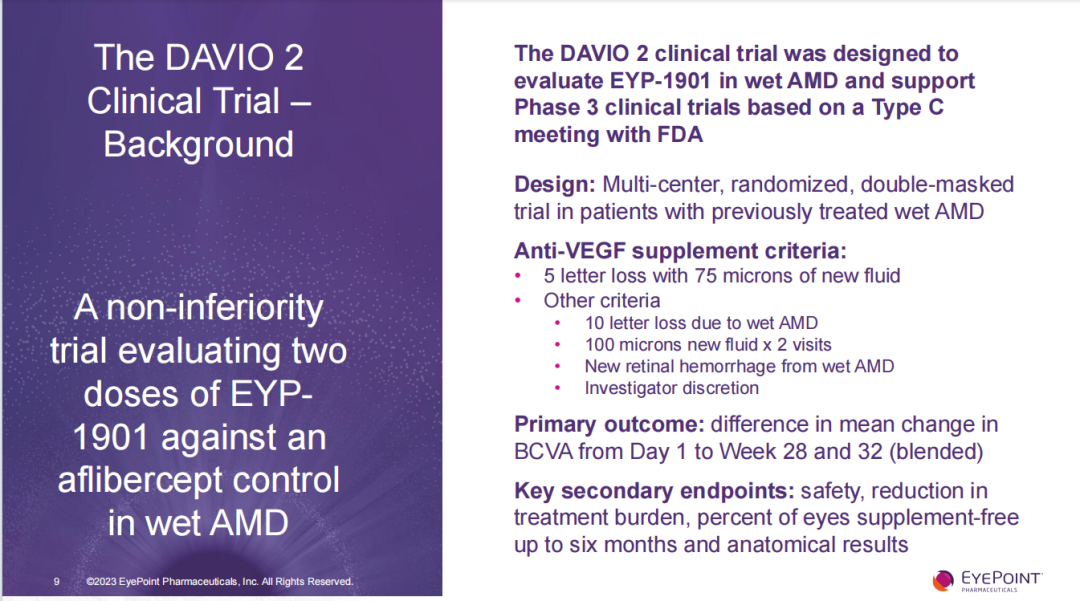
DAVIO 2試驗結果包括:
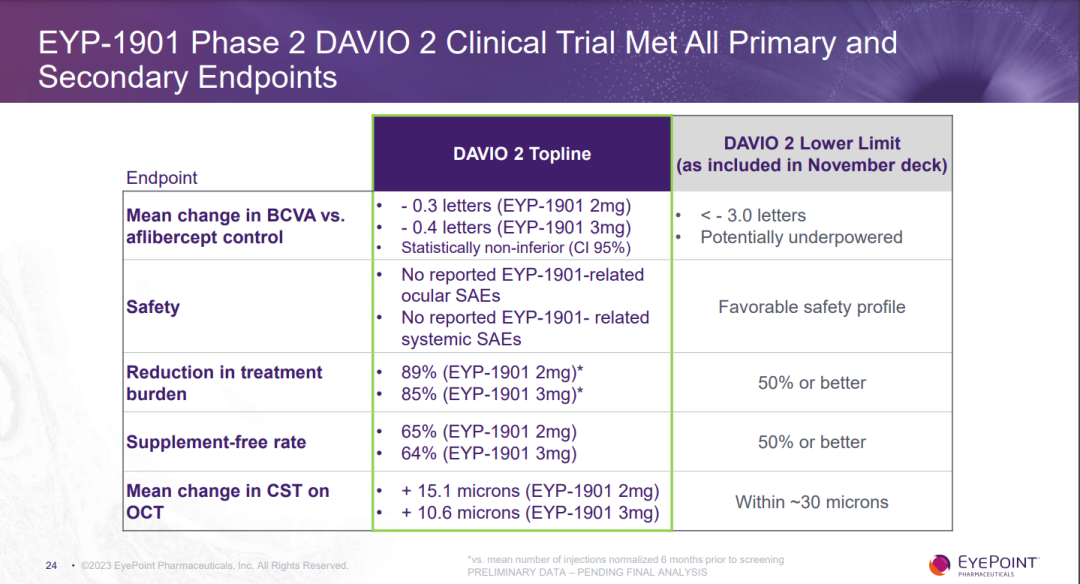
● EYP-1901劑量組(2mg和3mg)都達到了所有主要和次要終點。
● 結合28周和32周的數據,主要終點BCVA的變化對比阿柏西普對照組達到了統計學上的非劣效結論(95% CI):與阿柏西普對照組相比,EYP-1901劑量組(2mg和3mg)分別相差-0.3和-0.4個字母(FDA將非劣效下限定義為-4.5個字母)。
● 維持良好的安全性和耐受性:未發生與EYP-1901相關的眼科或系統嚴重不良事件(SAE)。
● EYP-1901劑量組(2mg和3mg)的治療負擔(注射頻率)分別減少了89%和85%。
● EYP-1901劑量組(2mg和3mg),65%和64%的受試者可以六個月內無需進行抗VEGF補救治療。
● 在32周時,與阿柏西普對照組相比,EYP-1901劑量組(2mg和3mg)在組織學上均體現出更好的疾病控制能力(OCT下中心視網膜厚度變化低于10微米)。
● 32周前的患者停藥率僅4%。
EYP-1901是將伏羅尼布和Durasert?技術相結合,形成的一種新的治療方案。2020年2月,貝達藥業控股子公司Equinox Sciences, LLC(Equinox)獨家授權EyePoint在中國(包括香港、澳門和臺灣)區域外以局部給藥方式開發伏羅尼布用于治療w-AMD、糖尿病視網膜病變(DR)和視網膜靜脈阻塞(RVO)。2022年5月,貝達藥業取得在中國(包括香港、澳門和臺灣)區域開發和商業化EYP-1901的獨家權利,EyePoint保留EYP-1901在全球其他地區的眼科權利。同時,Equinox獨家授權EyePoint在中國(包括香港、澳門和臺灣)區域外開發伏羅尼布用于所有局部給藥的眼科適應癥,包括糖尿病黃斑水腫(DME)。
關于EYP-1901
EyePoint的Durasert?技術是一種已批準上市的玻璃體內給藥系統,它將另一種藥物注射進入玻璃體內后緩釋,有效期可長達3年。
EYP-1901是將伏羅尼布和Durasert?技術相結合,形成了一種新的治療方案,可在門診辦公室注射,EYP-1901可生物降解,并且可以實現約9個月的藥物釋放。
關于伏羅尼布
伏羅尼布(商品名:伏美納?)是具有全新化學結構的新一代多靶點酪氨酸激酶血管內皮生長因子受體(VEGFR)/ 血小板衍化生長因子受體(PDGFR)抑制劑,可抑制腫瘤血管生成及生長,可用于治療病理性血管生成性疾病。2023年6月,伏羅尼布獲批上市,其與依維莫司聯合,用于治療既往接受過酪氨酸激酶抑制劑治療失敗的晚期腎細胞癌患者。
[1] 新聞原文及本篇引用數據鏈接如下:https://investors.eyepointpharma.com/news-releases/news-release-details/eyepoint-pharmaceuticals-announces-positive-topline-data-phase-2
https://investors.eyepointpharma.com/static-files/2f2e6f27-26f6-400f-9e52-a3fec5885ea7
下一條: 貝達藥業CFT8919片獲批開展臨床試驗
